Industria Textil e do Vestuário - Textile Industry - Ano XVI
Industria Textil e do Vestuário - Textile Industry - Ano XVI
A História da Tabela Periódica
Um pré-requisito necessário para construção da tabela periódica, foi a descoberta individual dos elementos químicos. Embora os elementos, tais
como ouro (Au), prata (Ag), Estanho (Sn), cobre (Cu), chumbo (Pb) e mercúrio
(Hg) fossem conhecidos desde a antiguidade. A primeira descoberta científica de
um elemento, ocorreu em 1669, quando o alquimista Henning Brand descobriu o
fósforo.
Durante os 200 anos seguintes, um grande volume de conhecimento relativo às
propriedes dos elementos e seus compostos, foram adquiridos pelos químicos. Com
o aumento do número de elementos descobertos, os cientistas iniciaram a
investigação de modelos para reconhecer as propriedades e desenvolver esquemas
de classificação.
A primeira classificação, foi a divisão dos elementos em metais e não-metais.
Isso possibilitou a antecipação das propriedades de outros elementos,
determinando assim, se seriam ou não metálicos.
"Acima, o fósforo (P). Primeiro elemento a ser descoberto.
Ponto de partida para a construção da tabela periódica".
As primeiras tentativas
A lista de elementos químicos, que tinham suas massas atômicas conhecidas, foi
preparada por John Dalton no início do século XIX. Muitas das massas atômicas
adotadas por Dalton, estavam longe dos valores atuais, devido a ocorrência de
erros. Os erros foram corrigidos por outros cientistas, e o desenvolvimento de
tabelas dos elementos e suas massas atômicas, centralizaram o estudo
sistemático da química.
Os elementos não estavam listados em qualquer arranjo ou modelo periódico, mas
simplesmente ordenados em ordem crescente de massa atômica, cada um com suas
propriedades e seus compostos.
Os químicos, ao estudar essa lista, concluíram que ela não estava muito clara.
Os elementos cloro, bromo e iôdo, que tinham propriedades químicas semelhantes,
tinham suas massas atômicas muito separadas.
Em 1829, Johann W. Boebereiner teve a primeira idéia, com sucesso parcial, de
agrupar os elementos em três - ou tríades. Essas tríades também estavam
separadas pelas massas atômicas, mas com propriedades químicas muito
semelhantes.
A massa atômica do elemento central da tríade, era supostamente a média das
massas atômicas do primeiro e terceiro membros. Lamentavelmente, muitos dos
metais não podiam ser agrupados em tríades. Os elementos cloro, bromo e iodo
eram uma tríade, lítio, sódio e potássio formavam outra.
Cloro, bromo e iôdo; A tríade da primeira tentativa.
Um começo sem muito sucesso.
A segunda tentativa
Um segundo modelo, foi sugerido em 1864 pôr John A.R. Newlands (professor de
química no City College em Londres). Sugerindo que os elementos, poderiam ser
arranjados num modelo periódico de oitavas, ou grupos de oito, na ordem
crescente de suas massas atômicas.
Este modelo, colocou o elemento lítio, sódio e potássio juntos. Esquecendo o
grupo dos elementos cloro, bromo e iodo, e os metais comuns como o ferro e o
cobre. A idéia de Newlands, foi ridicularizada pela analogia com os sete
intervalos da escala musical. A Chemical Society recusou a publicação do seu
trabalho periódico (Journal of the Chemical Society).
Nenhuma regra numérica, foi encontrada para que se pudesse organizar
completamente os elementos químicos numa forma consistente, com as propriedades
químicas e suas massas atômicas.
A base teórica na qual os elementos químicos estão arranjados atualmente -
número atômico e teoria quântica - era desconhecida naquela época e permaneceu
assim pôr várias décadas.
A organização da tabela periódica, foi desenvolvida não teoricamente, mas com
base na observação química de seus compostos, pôr Dimitri Ivanovich Mendeleev.
"Lítio, potássio e sódio; pela primeira vez, juntos no modelo
das oitavas de Newlands. A segunda tentativa frustrada e
impedida de ser publicada."
A Tabela Periódica, segundo Mendeleev
Dimitri Ivanovich Mendeleev (1834 –1907) nasceu na Sibéria, sendo o mais novo
de dezessete irmãos. Mendeleev foi educado em St. Petersburg, e posteriormente
na França e Alemanha. Conseguiu o cargo de professor de química na Universidade
de St. Petersburg. Escreveu um livro de química orgânica em 1861.
Em 1869, enquanto escrevia seu livro de química inorgânica, organizou os
elementos na forma da tabela periódica atual. Mendeleev criou uma carta para
cada um dos 63 elementos conhecidos. Cada carta continha o símbolo do elemento,
a massa atômica e suas propriedades químicas e físicas. Colocando as cartas em
uma mesa, organizou-as em ordem crescente de suas massas atômicas, agrupando-as
em elementos de propriedades semelhantes. Formou-se então a tabela periódica.
A vantagem da tabela periódica de Mendeleev sobre as outras, é que esta exibia
semelhanças, não apenas em pequenos conjuntos como as tríades. Mostravam
semelhanças numa rede de relações vertical, horizontal e diagonal. Em 1906,
Mendeleev recebeu o Prêmio Nobel por este trabalho.
"Mendeleev, o pai da tabela periódica. Através dos seus estudos, foi
possível desenvolver o modelo atual da tabela."
A descoberta do número atômico
Em 1913, o cientista britânico Henry Mosseley descobriu que o número de prótons
no núcleo de um determinado átomo, era sempre o mesmo. Mosseley usou essa idéia
para o número atômico de cada átomo. Quando os átomos foram arranjados de
acordo com o aumento do número atômico, os problemas existentes na tabela de
Mendeleev desapareceram.
Devido ao trabalho de Mosseley, a tabela periódica moderna esta baseada no
número atômico dos elementos.
A tabela atual se difere bastante da de Mendeleef. Com o passar do tempo, os
químicos foram melhorando a tabela periódica moderna, aplicando novos dados,
como as descobertas de novos elementos ou um número mais preciso na massa
atômica, e rearranjando os existentes, sempre em função dos conceitos
originais.
"Henry Moseley. Um passo importante na história da
evolução da tabela periódica"
As últimas modificações
A última maior troca na tabela periódica, resultou do trabalho de Glenn
Seaborg, na década de 50. À partir da descoberta do plutônio em 1940, Seaborg
descobriu todos os elementos transurânicos ( do número atômico 94 até 102).
Reconfigurou a tabela periódica colocando a série dos actnídeos abaixo da série
dos lantanídeos.
Em 1951, Seaborg recebeu o Prêmio Nobel em química, pelo seu trabalho. O
elemento 106 tabela periódica é chamado seabórgio, em sua homenagem.
O sistema de numeração dos grupos da tabela periódica, usados atualmente, são
recomendados pela União Internacional de Química Pura e Aplicada (IUPAC). A
numeração é feita em algarismos arábicos de 1 à 18, começando a numeração da
esquerda para a direita, sendo o grupo 1, o dos metais alcalinos e o 18, o dos
gases nobres.
O primeiro passo para se aprender química, é aprender a interpretar a Tabela Periódica: as divisões nela existentes, o por quê de cada
elemento estar localizado em determinado período ou família e quais
elementos são naturais e quais são sintéticos, todas essas dúvidas podem
ser esclarecidas com uma boa investigada na Tabela.
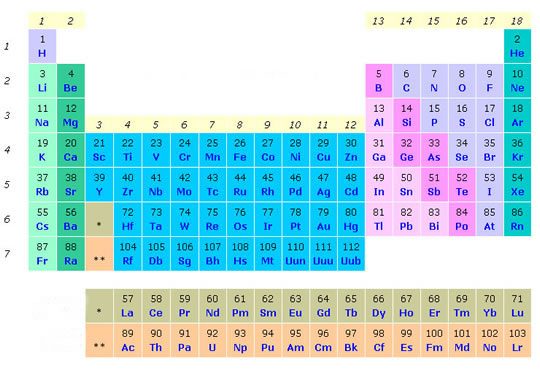
A tabela Periódica foi organizada com o intuito de facilitar seu estudo,
o posicionamento de cada elemento obedece à seguinte lei periódica:
“As propriedades físicas e químicas dos elementos são funções periódicas de seus números atômicos".
Comecemos por distinguir Períodos e Famílias:
Períodos: são as linhas horizontais da tabela, ao todo são sete períodos;
Famílias ou grupos: corresponde às linhas verticais da
tabela periódica, a tabela atual é constituída por 18 famílias. As
principais famílias estão destacadas em verde na figura acima, vejamos:
Família dos Alcalinos: Lítio (Li), Sódio (Na), Potássio (K), Rubídio (Rb), Césio (Cs), Frâncio (Fr).
Família dos Alcalino-terrosos: Berílio (Be), Magnésio (Mg) , Cálcio (Ca), Estrôncio (Sr), Bário (Ba), Rádio (Ra).
Família dos Gases Nobres: Hélio (He), Neônio (Ne), Argônio (Ar), Criptônio (Kr), Xenônio (Xe), Radônio (Rn).
A tabela também é subdivida de acordo com a natureza do elemento em
metal, semimetal, ametal, gás nobre, sendo que os elementos em rosa
constituem os semimetais (sete elementos).
A divisão é simples: os elementos que estão à esquerda dos semimetais
compreendem os metais (totalizam dois terços dos elementos) e os que se
localizam à direita são os ametais (11 elementos). Os gases nobres ficam
na extremidade direita da Tabela (parte verde).
Os dois períodos separados da Tabela compreendem os elementos de
Transição interna: série dos Lantanídeos (número atômico 57 a 71) e
Actinídeos (número atômico 89 a 103).
Bem-vindo a
Industria Textil e do Vestuário - Textile Industry - Ano XVI
© 2025 Criado por Textile Industry.
Ativado por
![]()
Você precisa ser um membro de Industria Textil e do Vestuário - Textile Industry - Ano XVI para adicionar comentários!
Entrar em Industria Textil e do Vestuário - Textile Industry - Ano XVI